Immunmediatoren der Cytomegalievirus Latenz
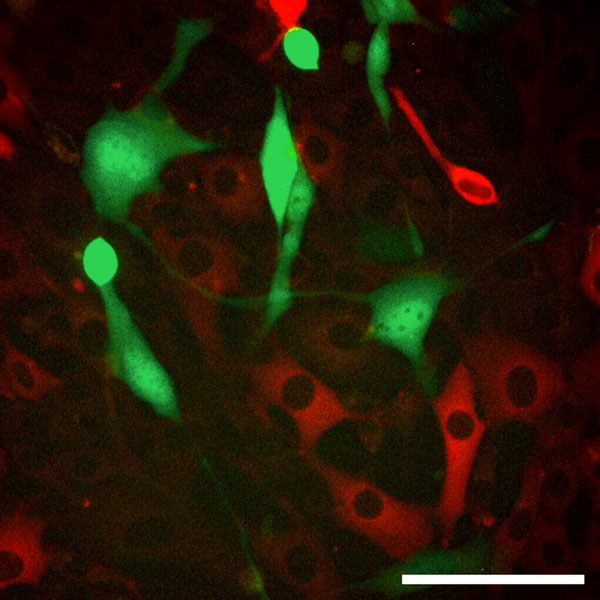
Abbildung 1: Interferon schützt Zellen vor einer MCMV Infektion.
Eine Reporter Zelllinie wurde mit Interferon beta vorbehandelt. In dieser Zellpopulation reagieren nicht alle Zellen auf Interferon (rote Genexpression bei Interferon Behandlung). Die Zellen wurden mit Maus Zytomegalievirus (MCMV) infiziert. Die virale Genexpression (grüne Genexpression) ist nur in Zellen sichtbar, die nicht auf Interferon reagiert haben.
„Einmal Herpes, immer Herpes“ – Dieser bekannte Satz beschreibt die Tatsache, dass eine Herpesvirus Infektion nicht erfolgreich geheilt werden kann. Nachdem das Virus seinen Wirt befällt, verbleibt es für immer in diesem Organismus und geht somit eine lebenslange Verbindung mit ihm ein. Diesen andauernden Zustand kann das Herpesvirus nur überstehen indem es nach der akuten Infektion in einer ruhenden Form in den Zellen verbleibt, den man als Latenz beschreibt. Cytomegalovirus (CMV) gehört zu der Familie der Herpesviren und verursacht keine nennenswerten Symptome in gesunden Menschen. Doch sobald das Immunsystem geschwächt ist, kann CMV aus der Latenz erwachen und gefährdet den Infizierten in hohen Maßen. Eine Reaktivierung von CMV ist besonders gefährlich für Patienten die eine Organtransplantation benötigen. Im Gegensatz zu anderen Herpesviren infiziert CMV viele unterschiedliche Zelltypen, unter anderen Endothelzellen und Knochenmarkszellen, und kann sich deshalb in vielen Organen vermehren und somit erheblichen und sogar lebensgefährlichen Schaden anrichten.
Nach einer Erstinfektion beginnt ein gesundes Immunsystem das, wozu es da ist: die Infektion zu bekämpfen, um das Leben des Infizierten zu retten. Im Falle von CMV ist es sogar so erfolgreich, dass keine ernsthafte Bedrohung entsteht. Die Etablierung der Latenz wiederum ist ein erfolgreicher viraler Mechanismus, um in gewissen Körperzellen zu verbleiben. Im Rahmen des Projekt B2 versuchen wir zu verstehen, ob die erste Immunreaktion des Körpers einen Einfluss auf die CMV Latenz hat. Typ I Interferone werden von infizierten Zellen umgehend ausgeschüttet und hemmen die Virusvermehrung sehr effektiv. Es ist allerdings nicht geklärt, inwieweit Interferone eine Rolle während der Latenz und Reaktivierung spielen. Auch die Frage in welchen Zelltypen CMV latent bleibt ist noch offen. Mithilfe unterschiedlicher Methoden versuchen wir das komplexe Wechselspiel zwischen Wirtszelle und CMV in Bezug auf virale Latenz näher zu ergründen. Untersuchungen in speziellen Zelltypen werden durch die Deletion von Interferon-relevanten Genen mit Crispr/Cas9 Aufschluss über die Relevanz von Typ I Interferonen während der CMV Latenz geben. Außerdem werden die Latenz und der Einfluss von Interferonen direkt im Körper untersucht, indem wir das viel beschriebene CMV Mausmodell anwenden.
Wissenschaftliche Vorgehensweise
Typ I Interferone spielen während einer Primärinfektion mit CMV eine wichtige Rolle, die Beteiligung in Bezug auf Latenz und Reaktivierung ist jedoch noch unklar. Insbesondere die Bedeutung von spezifischen Signalwegen als Antwort auf eine Immunreaktion ist noch nicht ausreichend geklärt. Außerdem beschränkte sich die Untersuchung der CMV Latenz auf Knochenmarkszellen und ließ die Frage offen in wie weit andere Zelltypen während der Latenz eine Rolle spielen.
In der Vergangenheit konnten wir zeigen, dass Typ I Interferone eine wichtige Funktion auf die Kontrolle der Latenz in vivo und in vitro haben. Wir entwickelten eine Zelllinie, in der wir die Interferonantwort mithilfe Fluoreszenzgenexpression sichtbar machen konnten (RAND et al, 2012). Interessanterweise reagieren nicht alle Zellen auf Interferon, selbst wenn hohe Konzentrationen an Interferon verwendet wurden. Nach Infektion dieser Zellen konnte virale Genexpression nur in Zellen beobachtet werden, die nicht auf Interferon reagierten. Außerdem wurde eine Leberendothelzelllinie (LSECs) generiert, da Studien gezeigt haben, dass der Maus CMV (MCMV) dort latent ist (DAG et al. 2013).
Mit diesen Zellen konnte in vitro gezeigt werden, dass mit Typ I Interferon Zugabe MCMV nicht aktiv replizierte, aber trotzdem in den Zellen verweilte, da nach Interferon Rücknahme MCMV reaktivierte (DAG et al. 2014). Zusätzlich konnten wir in vivo zeigen, dass die Latenz eines weiteren Herpesvirus, nämlich der gamma-Herpesvirus MHV68 (das Analog zu KSHV und EBV), durch Typ I Interferon kontrolliert wird (SCHWERK et al, Manuscript in preparation).
Die genaueren Mechanismen, die Interferon und CMV Latenz verbindet, sollen in diesem Teilprojekt näher analysiert werden. Hierzu werden Cas9-induzierte Deletionen mehrerer Interferon-stimulierter Gene durchgeführt. Es werden unter anderem humane Endothelzellen verwendet, um die Arbeiten mit dem humanen CMV (HCMV) zu vertiefen. Weiterhin werden verschiedene Mauslinien, die keinen Interferonrezeptor auf unterschiedlichen Zelltypen haben, mit MCMV infiziert, um die Rolle von Typ I Interferon auf die CMV Latenz in vivo zu untersuchen.
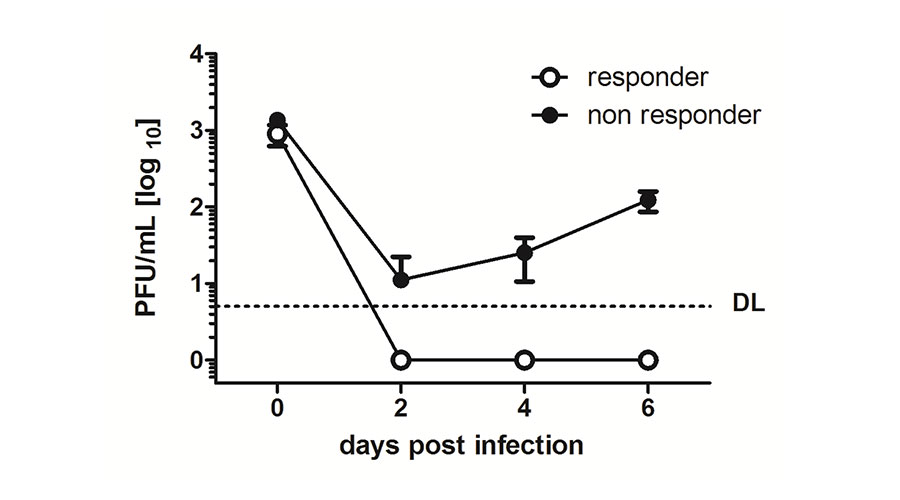
Abbildung 2: MCMV kann sich nicht in Zellen vermehren, die auf Interferon beta reagieren.
Eine Reporter Zelllinie wurde mit Interferon beta vorbehandelt und mit Hilfe des roten Fluoreszenzfarbstoffes wurden nur die Zellen, die auch auf Interferon reagieren, isoliert und anschließend mit MCMV infiziert (responder, weiße Kreise). Gleichzeitig wurden die Zellen infiziert, die nicht auf Interferon reagieren (non-responder, schwarze Kreise). Nach 2, 4 und 6 Tagen wurden die Zellüberstände abgenommen und auf andere Zellen gegeben, um den Virus im Überstand zu titrieren und die Plaque Forming Unit (PFU) zu bestimmen. Der Virus konnte nur auf den nicht-reagierenden Zellen nachgewiesen werden.
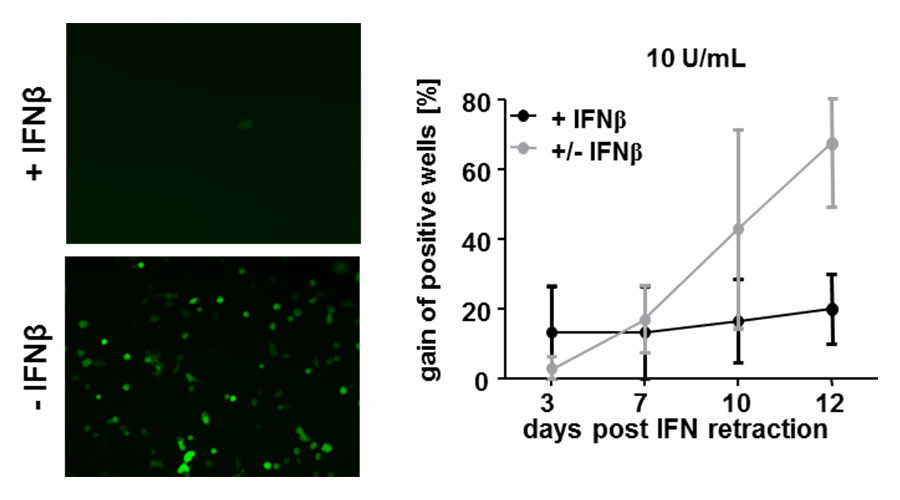
Abbildung 3: Bei Interferon Rücknahme ist MCMV wieder aktiv.
Leberendothelzellen wurden mit Interferon beta vorbehandelt und anschließend mit MCMV infiziert. Virale Genexpression (grün) ist sichtbar, wenn die Zellen nicht mit Interferon beta behandelt wurden (linkes Bild). Für 7 Tage wurden die MCMV-infizierten Zellen mit Interferon versorgt. Nach dem 7. Tag wurde den Zellen Medium ohne Interferon gegeben und die virale Genexpression wurde bis Tag 12 nach Interferon Rücknahme beobachtet (+/- IFNb, graue Linie). Als Kontrolle wurden Zellen infiziert, die für die gesamte Zeit Interferon bekamen (+ IFNb, schwarze Linie). 7 Tage nachdem Interferon nicht mehr zu den Zellen gegeben wurde, konnte virale Genexpression wieder detektiert werden.
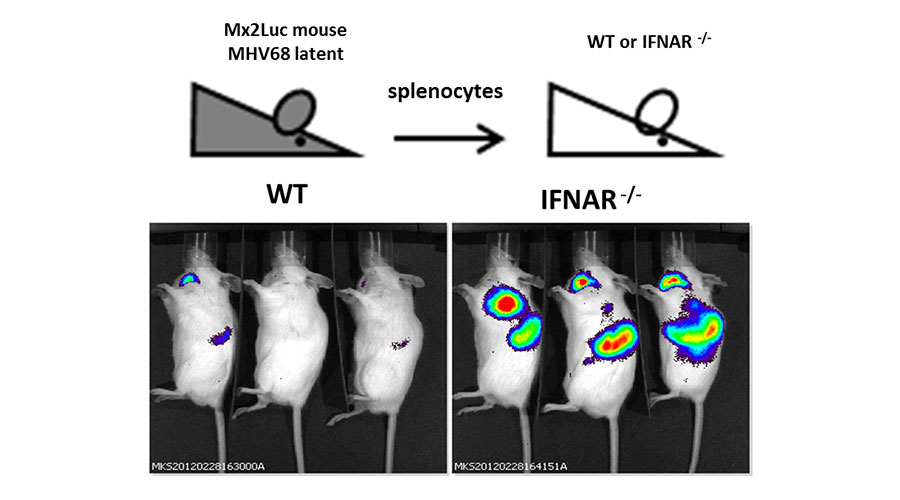
Abbildung 4: Interferon wird induziert nachdem MHV68 in vivo reaktiviert.
Mx2Luc reporter Mäuse wurden mit MHV68 latent infiziert und Splenozyten wurden von diesen Mäusen isoliert. Diese latent infizierten Splenozyten wurden entweder in Wildtyp (WT) oder IFN Typ I Rezeptor Knockout (IFNAR -/-) Mäusen transferiert. Nach 7 Tagen wurde bei diesen Mäusen ein Ganzkörper in vivo Imaging durchgeführt, um die Aktivität des luc-reporters in den transferierten Splenozyten, der die IFN Aktivität anzeigt, zu veranschaulichen.
Luka Cicin-Sain und Ulrich Kalinke erzählen über ihre Forschung im SFB 900
Das Projekt B2 wurde seit der Gründung des SFBs im Jahr 2010 von Luca Cicin-Sain und Hansjörg Hauser geleitet. Seit Juli 2018 ist nun Ulrich Kalinke im Team mit Luka Cicin-Sain für die Leitung des Projektes verantwortlich. Dabei widmen sich die beiden der Frage, wie körpereigene Interferone eine latente Herpesvirus-Infektion beeinflussen. Es werden vorrangig Infektionen mit dem Cytomegalievirus untersucht.
Publikationen des Forschungsprojektes B2
Kontakt

Prof. Dr. sci. Dr. med. Luka Cicin-Sain
Helmholtz-Zentrum für Infektionsforschung (HZI)
Immunalterung und chronische Infektionen
Inhoffenstr. 7
38124 Braunschweig
+49 531 6181-4616
Luka.Cicin-Sain@helmholtz-hzi.de

Prof. Dr. Ulrich Kalinke
Zentrum für Experimentelle und Klinische Infektionsforschung (Twincore)
Institut für Experimentelle Infektionsforschung
Feodor-Lynen-Str. 7
30625 Hannover
+49 220027-112
ulrich.kalinke@twincore.de