Neuartige Wirts-modulatorische Faktoren von Helicobacter-Spezies
Chronisch-entzündliche bakterielle Infektionserreger sind selten, können schwere Erkrankungen bis hin zum Krebs verursachen und sind meist schwierig zu bekämpfen, weil sie verschiedenste Eigenschaften haben, das Immunsystem des Wirtsorganismus zu unterwandern und zu manipulieren. Ein Paradebeispiel ist der bakterielle Erreger schwerwiegender Magenerkrankungen des Menschen, Helicobacter pylori. H. pylori wird meist im Kleinkindalter erworben und kann auch schon bei Kindern und Jugendlichen schwere Symptome hervorrufen, beispielweise Blutarmut, Wachstumsstörungen und perforierende Magengeschwüre. Im fortgeschrittenen Alter nehmen bei infizierten Personen Geschwüre des Magens und Duodenums deutlich zu, und es kann unter der Infektion auch zur Entwicklung verschiedener Krebserkrankungen des Magens kommen. Wenn man die gesamte Weltbevölkerung betrachtet, ist diese Infektion eine der häufigsten weltweit, da ungefähr 50% aller Menschen den Erreger in sich tragen. Dabei hat jeder einzelne Mensch seinen individuell angepassten Bakterienstamm, da die Bakterien sich nach Übertragung sehr schnell verändern. Eine Spontanheilung der Infektion kommt nur selten vor. Ebenfalls gibt es bisher keine einfache Behandlungsmethode der Infektion und keine vorbeugende Schutzimpfung. Eng verwandte Bakterien können ähnliche chronische Infektionen und Entzündungen des Magen-Darmtrakts bei Mensch und Tier verursachen. Die Biologie der chronischen Infektion dieser Erreger ist daher von großem Interesse.
Wissenschaftliche Vorgehensweise
Die Forschergruppe um Christine Josenhans beschäftigt sich daher mit der Aufklärung von Mechanismen, die Helicobacter pylori und verwandte Erreger dazu befähigen, das Immunsystem des Wirts auszuhebeln und eine chronisch-aktive Infektion dadurch erst zu ermöglichen. Die Mitarbeiter ihrer Arbeitsgruppe haben dabei vor allem ein Virulenzmodul dieser Bakterien im Blick, die Pathogenitätsinsel CagPAI. Die Erbinformation dieser Insel erzeugt ein komplexes Transportsystem in der Bakterienhülle, das die Bakterien befähigt, mit der Wirtszelle in Kontakt zu treten und verschiedene Signale an Wirtzellen auszusenden. Diese Signale aktivieren beispielsweise die chronische Entzündung und die langzeitliche Ansiedlung des Bakteriums in der Magenschleimhaut des Menschen. Auch spielt die CagPAI bei der Beförderung von Krebserkrankungen eine treibende Rolle.
Die Gruppe um C. Josenhans untersucht die Interaktion von Proteinen der CagPAI miteinander und mit Rezeptoren der Wirtszelloberfläche. Ebenfalls wird aufgeklärt, wie und welche Faktoren zur Veränderung der Wirtszelle durch das System der Bakterien ausgeschleust werden und welche Wirtsfaktoren dadurch beeinflusst werden. Diese Untersuchungen geben auch entscheidenden Aufschluss über Angriffspunkte der Bakterien, die für neue Therapien und die Verbesserung von Impfstoffen genutzt werden können.
Die Arbeitsgruppe bedient sich zur Aufklärung dieser Mechanismen zahlreicher Methoden der Biochemie, Mikrobiologie, Immunologie und der zellulären Signaltransduktion. Ebenfalls kommen ausgeklügelte Infektionsmodelle zum Einsatz. Eine besondere Herangehensweise beinhaltet die evolutionäre genetische Analyse. Dabei werden bei diesen sehr variablen Bakterien mit gesamt- und teilgenomischen Sequenzierungen und mathematischen Methoden die weltweit im Menschen und im Tiermodell der Infektion vorkommenden Veränderungen in Genen, die für Proteine der Wirtsinteraktion und der bakteriellen Zellhülle kodieren, abgeleitet und analysiert. Auch zusätzliche Informationen über die Selektion im Wirt und die Proteininteraktionen an der Oberfläche der Bakterien sowie zwischen Bakterium und Wirtszelle können dadurch gewonnen werden. Diese Informationen werden genutzt, um beispielsweise gezielt Aufschluss über die Stabilität und Umweltabhängigkeit spezifischer Wirtsinteraktionsschnittstellen der Bakterien zu geben.
Zusätzlich werden biochemische und mikroskopische Methoden genutzt, die metabolische oder inflammatorische Anpassungen der Bakterienzellhülle an die variable und fluktuierende Wirtssituation messbar machen.
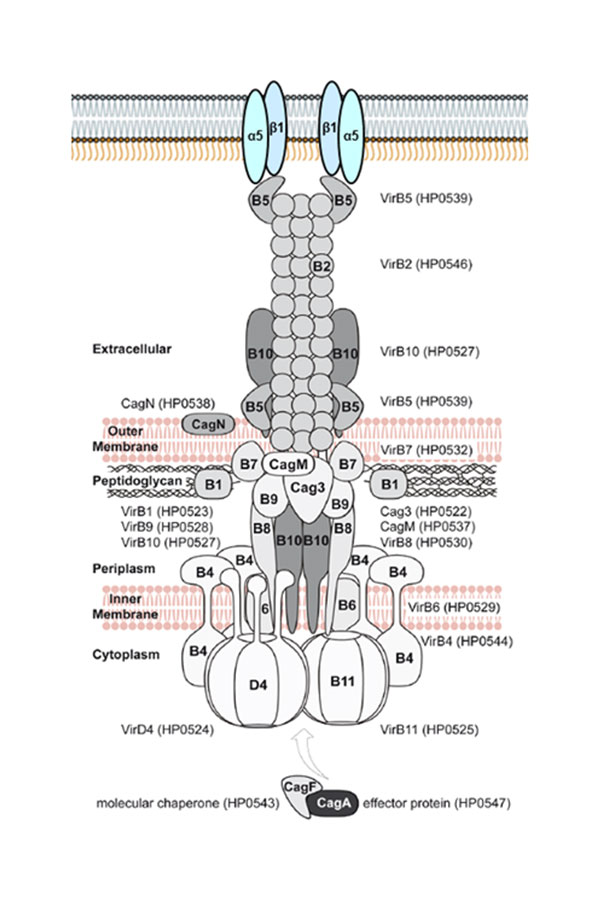
Das Virulenzmodul CagPAI in der Zellhülle von Helicobacter pylori im Kontakt mit Integrinen der menschlichen Wirtszelle (aus: Olbermann et al., PLoS Genetics, 2010)
Christine Josenhans erzählt über ihre Forschung im SFB 900
Christine Josenhans ist seit Gründung des SFBs im Jahr 2010 mit dabei und erforscht mit ihrem Team Mechanismen, die es Helicobacter pylori und verwandten Bakterien ermöglichen, eine dauerhafte Infektion herbeizuführen.
Publikationen des Forschungsprojektes B6
Kontakt

Prof. Dr. rer. nat. Christine Josenhans
Dept. of Medical Microbiology and Hospital Epidemiology
Max von Pettenkofer Institut
Ludwig Maximilians Universität München
Pettenkoferstrasse 9a
80336 München
+49 8921 8072 826
josenhans@mvp.uni-muenchen.de
