Konformationelle Flexibilität der Hepatitis C Virus Glykoproteine als virale Evasionsstrategie gegen neutralisierende Antikörper
Das Hepatitis C Virus (HCV) ist mit ca. 180 Millionen infizierten Patienten und geschätzten 350.000 HCV-assoziierten Todesfällen im Jahr einer der bedeutsamsten viralen Krankheitserreger. Die HCV Infektion verläuft in der großen Mehrheit der Fälle chronisch, größtenteils weil der menschliche Organismus keine geeigneten Abwehrmechanismen findet, um sich gegen das Virus zur Wehr zu setzen. Eine der bedeutendsten Waffen des menschlichen Abwehrsystems gegen virale Erkrankungen sind neutralisierende Antikörper, die an spezielle Oberflächenstrukturen des Virus binden und dadurch eine Infektion der Wirtszelle verhindern. HCV hat jedoch vielfältige Strategien entwickelt, entweder die Bildung oder die neutralisierende Aktivität dieser Antikörper zu unterwandern.
Die Forschergruppe um Thomas Krey erforscht die Interaktionen von neutralisierenden Antikörpern mit den viralen Oberflächenstrukturen des HCV – auch Neutralisationsepitope genannt – mittels Röntgenkristallographie. Die Forscher bestimmen dabei die 3D Struktur der Neutralisationsepitope in Komplex mit spezifischen Antikörpern. Zusammen mit einer Analyse der neutralisierenden Aktivität dieser Antikörper erlaubt es diese Struktur einzuschätzen, welches der untersuchten Neutralisationsepitope die Bildung besonders effizienter neutralisierender Antikörper induziert und sich daher gut als Impfstoff eignen würde.
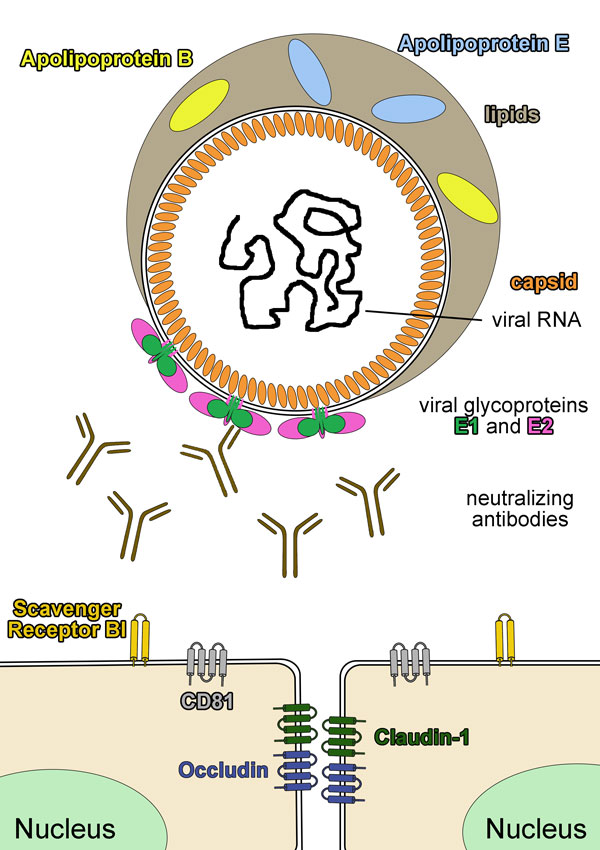
Derzeit hat man von der 3D-Struktur der viralen Eiweiße, die auf der Virusoberfläche präsent sind (Glykoproteine E1 und E2), nur ein begrenztes Verständnis, obwohl dies bei vielen anderen Viren wie z.B. dem Influenza-Virus oder HIV schon einen großen Schritt in Richtung eines effizienten Impfstoffs ermöglicht hat. Daher konzentrieren sich die Forscher bei ihren Untersuchungen auf einen nativen HCV Glykoproteinkomplex, der möglichst genauso aufgebaut ist wie der in der Virushuelle enthaltene.
Wissenschaftliche Vorgehensweise
Die große Mehrheit der mit Hepatitis C Virus (HCV) infizierten Patienten ist unfähig, im Verlauf einer akuten Infektion das Virus vollständig aus dem Körper zu beseitigen. Derzeit ist jedoch noch unklar, worauf dieses Versagen des menschlichen Immunsystems zurückzuführen ist. Zahlreiche Studien in den letzten Jahren haben die Bedeutung von neutralisierenden Antikörpern (nAk) für die effiziente Bekämpfung des Virus hervorgehoben. Insbesondere die durch strukturbiologische Studien gewonnene atomare Auflösung von Strukturen wichtiger Antigen-Antikörperkomplexe (entweder lösliche HCV E2 Fragmente oder synthetische Epitop-Peptide) haben die rationale Impfstoffentwicklung massiv vorangetrieben. Die relevanten Epitope liegen in den beiden Glykoproteinen E1 und E2, die im Virion als nicht-kovalent gebundenes Heterodimer oder als kovalent gebundenes Multimer vorliegen. Leider stammen die vorliegenden strukturellen Informationen aber ausschließlich von Proteinfragmenten oder Peptiden. Das Hauptziel des Teilprojekts B10 ist daher die Strukturbestimmung der HCV Glykoproteine in ihrem nativen Zustand, um die Anordnung der Neutralisationsepitope im infektiösen Virion zu verstehen.
Zu diesem Zweck wenden wir eine integrierte strukturbiologische Herangehensweise mit verschiedenen biophysikalischen, biochemischen und strukturbiologischen Methoden an. In Zusammenarbeit mit Prof. Thomas Pietschmann (Projekt A6) untersuchen wir den Einfluss dieser nativen Glykoproteine auf die Infektion der Wirtszelle.
Kürzlich haben wir und andere Labors zeigen können, dass zumindest ein Teil der Neutralisationsepitope in den HCV Glykoproteinen strukturell flexibel sind und diese Flexibilität wurde als Evasionsstrategie postuliert, die zu der Entwicklung einer chronischen HCV Infektion beitragen kann. In diesem Kontext ist ein weiteres Ziel, die Antikörperantwort gegen diese strukturell flexiblen Epitope in infizierten Patienten genauer zu charakterisieren. Unsere Ergebnisse werden zu einem besseren Verständnis der Interaktion zwischen Virushülle und dem humoralen Immunsystem führen, welches eine essentielle Voraussetzung für die Entwicklung eines sicheren und effizienten HCV Impfstoffes ist.
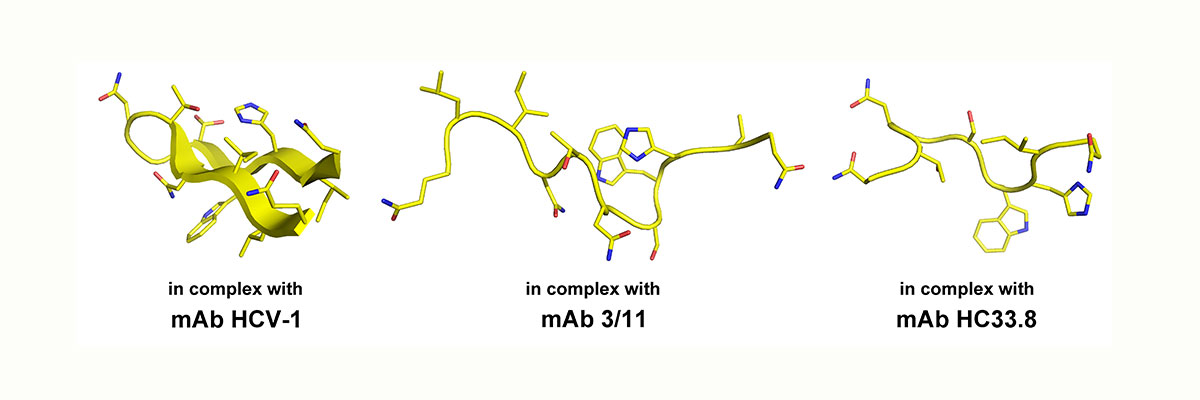
Struktuelle Flexibilität eines wichtigen Neutralisationsepitops in HCV E2. Gezeigt ist die Konformation des Peptids aa412-423 gebunden an drei verschiedene neutralisierende Antikörper.
Thomas Krey erzählt über seine Forschung im SFB 900
Thomas Krey ist erst im Mai 2016 dem SFB beigetreten. In seinem Teilprojekt B10 wird der Frage nachgegangen, wie Oberflächenstrukturen von Hepatitis C Viren mit neutralisierenden Antikörpern interagieren. Dazu bedient sich die Forschergruppe hauptsächlich mit strukturbiologischen Methoden wie Röntgenkristallographie.
Publikationen des Forschungsprojektes B10
Kontakt

Prof. Dr. med. vet. Thomas Krey
Institut für Virologie
Medizinische Hochschule Hannover
Carl-Neuberg-Str. 1
30625 Hannover
+49 511 532-4308
Krey.Thomas@mh-hannover.de