Interaktion des Hepatitis C-Virus mit Lipoproteinen und dessen Rolle für Infektion und Virus-Persistenz
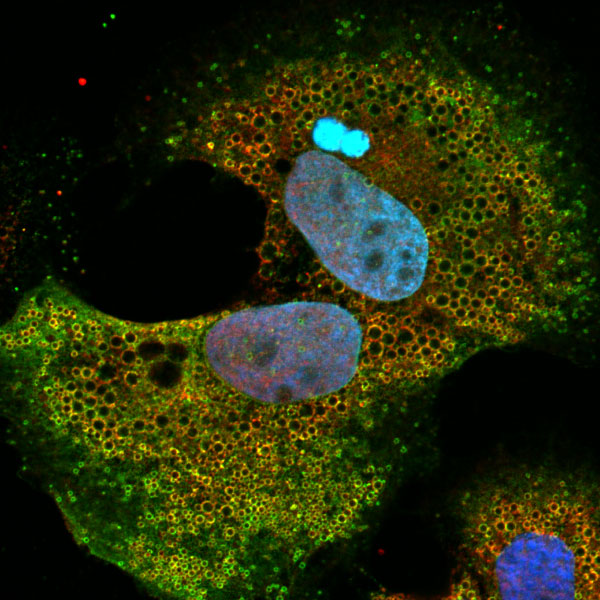
Das zelluläre Protein ABHD5 (rot gefärbt) reichert sich in Leberzellen auf der Oberfläche der sogenannten Lipid Droplets (in grün) an. Lipid Droplets lagern Lipide innerhalb der Zelle und spielen eine wichtige Rolle für die Assemblierung von Hepatitis C-Viruspartikeln. ABHD5 ist einer der Faktoren, die an diesem Prozess beteiligt sind. Die Zellkerne sind blau gefärbt.
Hepatitis C, die chronische Infektion mit dem Hepatitis C-Virus (HCV) ist weiterhin ein globales Gesundheitsproblem. Hepatitis C ist zwar heilbar, allerdings wissen viele Patienten nichts von ihrer Infektion und aufgrund hoher Kosten steht die Therapie nicht jedem zur Verfügung. Dies gilt insbesondere für ressourcenärmere Gegenden der Erde, wo gleichzeitig die Prävalenz von HCV am höchsten ist. Außerdem schützt die erfolgreiche medikamentöse Beseitigung des Virus nicht vor Wiederansteckung. Deshalb besteht die Notwendigkeit für einen prophylaktischen Impfstoff, um die durch HCV verursachte Krankheitslast weiter zu verringern. HCV hat verschiedene Strategien entwickelt, um sich den angeborenen, zellulären und humoralen Immunantworten zu entziehen und eine chronische Infektion zu etablieren. Die Verbindung von HCV-Partikeln mit humanen Lipoproteinen ermöglicht den Partikeln, in die Leber zu gelangen und sich vor neutralisierenden Antikörper zu schützen. Außerdem können Variationen in humanen Lipoprotein-Genen wie ApoE den Verlauf der HCV-Infektion beeinflussen.
In diesem Projekt untersuchen Thomas Pietschmann und seine Mitarbeiter die Mechanismen, die die Interaktion zwischen HCV und humanen Lipoproteinen steuern und wie Lipoproteine den Verbindung Zelleintritt und Schutz vor Antikörpern vermitteln. Langfristig tragen diese Studien zum Verständnis grundlegender Mechanismen der HCV-Replikation bei. Darüber hinaus können diese Informationen in die Entwicklung von HCV-Impfstrategien einfließen. Bisher sind die zellulären Signalwege und molekularen Maschinen, die an der Interaktion zwischen HCV und den Lipoproteinen beteiligt sind, unvollständig verstanden. Dieses Projekt soll diese Verknüpfungen mit Hilfe von verschiedenen Methoden, die im Labor von Thomas Pietschmann etabliert sind, aufklären.
Wissenschaftliche Vorgehensweise
Wir charakterisieren die Struktur und Funktion von zellulären und viralen Multi-Protein-Komplexen während der HCV-Assemblierung mittels einer Kombination aus zellbiologischen, virologischen und quantitativ-proteomischen Ansätzen. Dadurch und mit Hilfe der Verwendung verschiedener Virusmutanten, die in bestimmten Schritten von HCV-Assemblierung und -Freisetzung arretiert sind, untersuchen wir die Funktion und Zusammensetzung von Multi-Protein-Komplexen im Verlauf der Assemblierung und Virusreifung. Mögliche Kandidaten, die wir so identifizieren, werden mittels RNA-Interferenz verifziert. Die detaillierte Analyse von Zusammensetzung der HCV-Partikel, ihre spezifische Infektiösität, Rezeptor-Interaktionen sowie die Neutralisierung durch Antikörper soll den Einfluss von Lipoprotein-Interaktionen auf den Vorgang des HCV-Zelleintritts enthüllen. Zusammengenommen werden uns diese Arbeiten helfen, die zellulären Faktoren zu definieren, die die HCV-Lipoprotein-Interaktion steuern und dadurch die Persistenz des Virus ermöglichen.

Lorem ipsum dolor sit amet, consetetur sadipscing elitr, sed diam nonumy.
Thomas Pietschmann erzählt über seine Forschung im SFB 900
Thomas Pietschmann ist seit Gründung des SFBs im Jahr 2010 mit dabei. In seinem Teilprojekt A6 wird die Interaktion der Hepatitis C-Viren mit humanen Lipoproteinen untersucht.
Publikationen des Forschungsprojektes A6
Kontakt

Prof. Dr. rer. nat. Thomas Pietschmann
TWINCORE – Zentrum für Klinische und Experimentelle Infektionsforschung
Experimentelle Virologie
Feodor-Lynen Str. 7
30265 Hannover
+49 511 220027-130
Thomas.Pietschmann@twincore.de