Das Zusammenspiel von EBV-induzierten γδ und αβ T-Zellen während chronischer EBV Reaktivierung, PTLD, und EBV-gerichteten zellulären Therapie in Transplantempfängern
Epstein Barr Virus (EBV) ist der Erreger der infektiösen Mononukleose („Pfeiffersches Drüsenfieber“). Nach einer ersten Infektion meist im Kindes- bis Jugendalter nistet sich das Virus in den B-Zellen des Immunsytems lebenslang ein und wird vom gesunden Immunsystem kontrolliert. Wird die Immunität geschwächt, z.B. nach Transplantation und bei Patienten, die immunschwächende Medikamente einnehmen müssen, kann EBV sich unkontrolliert vermehren und dann zur Ausbildung von bösartigen Tumorerkrankungen (Lymphoproliferative Erkrankungen, Weichteiltumore) führen.
T-Zellen des Immunsystems können EBV kontrollieren. Die Hauptaufgabe fällt dabei den gut beschriebenen αβ T-Zellen zu. In letzter Zeit gibt es vermehrt Hinweis über einen Beitrag der selteneren γδT-Zellen zur Virusbekämpfung, z.B. auch aus dem Teilprojekt B8 für die CMV Infektion. Wir wollen in diesem Projekt untersuchen, welchen Beitrag γδ T-Zellen zur Bekämpfung der EBV-Infektion beim gesunden Patienten leisten und wie sich dieses Zusammenspiel mit αβ T-Zellen unter Immunsuppression ändert. Eine therapeutische Option für Transplantationspatienten mit EBV-assoziierten Problemen ist der Transfer von aufgereinigten EBV-spezifischen T-Zellen von gesunden Spendern. Dies sind in der Regel fast ausschließlich αβ T-Zellen, wir wollen die Rolle der Patienten-eigenen γδ T-Zellen bei der Wirksamkeit der transferierten EBV-spezifischen T-Zellen im Patienten charakterisieren.
Wissenschaftliche Vorgehensweise
Für die EBV-assoziierte Lymphoproliferation können wir im Labor B-Zellen mit EBV infizieren und dann die Immunreaktion dagegen in verschiedenen Konstellationen prüfen. Neben der reinen Zahl der EBV-spezifischen αβ und γδ T-Zellen wird deren Aussehen anhand von Oberflächenmarkern und ihre Funktion in Zytokin und Zelllysetests untersucht. Sequenzierungen der T-Zellrezeptoren sollen zeigen, welche spezifischen T-Zellklone durch EBV stimuliert werden und expandieren. Erkenntnisse, die wir in diesem System gewinnen, werden wir auf eine Kohorte von Nieren- und Leber-transplantierten Patienten übertragen, die unter den notwendigen immununterdrückenden Medikamenten entweder eine EBV-Infektion gut überwunden haben oder chronisch EBV in ihrem Blut nachweisbar haben.
In einem letzten Schritt werden wir den Verlauf von αβ und γδ T-Zellen bei Patienten, die einen EBV-spezifischen T-Zelltransfer erhalten, verfolgen. Wir werden evaluieren, inwieweit die mit dem Präparat nicht übertragenen γδ T-Zellen zum Erfolg der Zelltherapie beitragen. Über T-Zellrezeptorsequenzierungen wollen wir der Frage nachgehen, ob es spezifische Sequenzen für EBV gibt und diese mit Sequenzen bei anderen Viruserkrankungen (z.B. CMV, TP B8; Hepatitis) vergleichen, um mögliche gemeinsame Sequenzen zu identifizieren.
Langfristig erwarten wir, durch diese Untersuchungen Erkenntnisse über Fehlregulierungen bei immunsupprimierten Patienten zu gewinnen und die Wirksamkeit von T-Zellpräparaten durch Unterstützung weiterer Zellfraktionen zu verbessern.
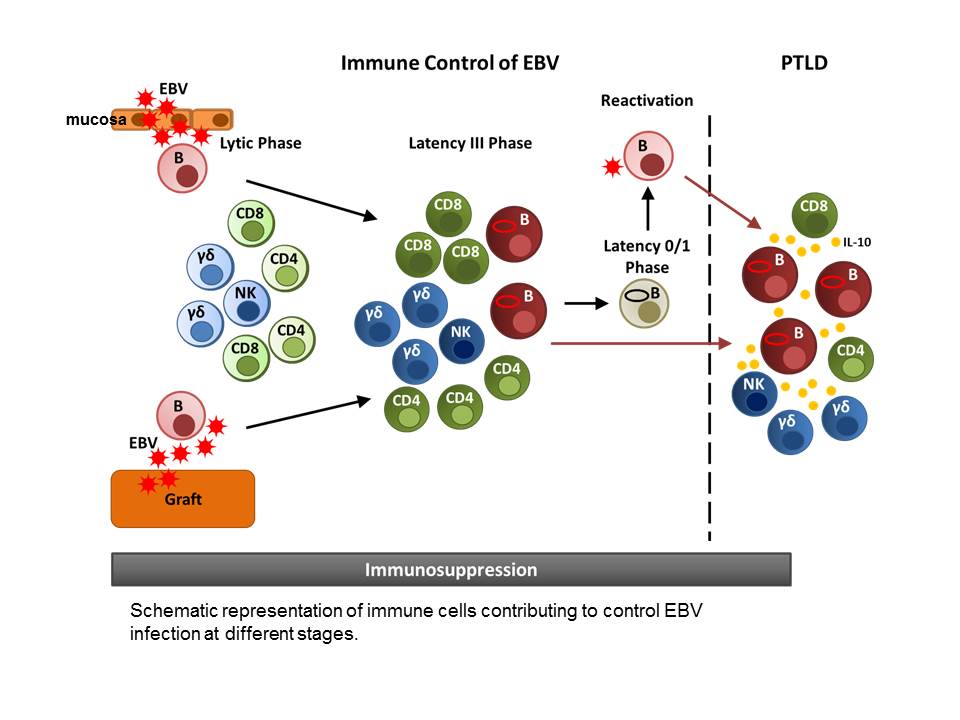
Schematische Darstellung von Immunzellen, die zur Kontrolle der EBV-Infektion in verschiedenen Stadien beitragen.
Britta Maecker-Kolhoff erzählt über ihre Forschung im SFB 900
Britta Maecker-Kolhoff ist in der dritten Förderperiode im Jahr 2018 dem SFB beigetreten. In ihrem gemeinsamen Teilprojekt B11 mit Britta Eiz-Vesper und Sarina Ravens wird der Frage nachgegangen, wie verschiedene T Zell Typen während einer chronischen Reaktivierung des Epstein-Barr-Virus und einer zellulären Therapie gegen EBV in Transplantationspatienten zusammenspielen.
Sarina Ravens erzählt über ihre Forschung im SFB 900
Sarina Ravens ist in der dritten Förderperiode im Jahr 2018 dem SFB beigetreten. In ihrem gemeinsamen Teilprojekt B11 mit Britta Eiz-Vesper und Britta Maecker-Kolhoff wird der Frage nachgegangen, wie verschiedene T Zell Typen während einer chronischen Reaktivierung des Epstein-Barr-Virus und einer zellulären Therapie gegen EBV in Transplantationspatienten zusammenspielen.
Britta Eiz-Vesper erzählt über ihre Forschung im SFB 900
Britta Eiz-Vesper ist in der dritten Förderperiode im Jahr 2018 dem SFB beigetreten. In ihrem gemeinsamen Teilprojekt B11 mit Britta Maecker-Kolhoff und Britta Sarina Ravens wird der Frage nachgegangen, wie verschiedene T Zell Typen während einer chronischen Reaktivierung des Epstein-Barr-Virus und einer zellulären Therapie gegen EBV in Transplantationspatienten zusammenspielen.
Publikationen des Forschungsprojektes B11
Kontakt

Prof. Britta Maecker-Kolhoff
Klinik für Pädiatrische Hämatologie und Onkologie
Medizinische Hochschule Hannover
Carl-Neuberg-Str. 1
30625 Hannover
+49 511 532-6747
maecker-kolhoff.britta@mh-hannover.de

Dr. rer. nat. Sarina Ravens
Institut für Immunologie
Medizinische Hochschule Hannover
Carl-Neuberg-Str. 1
30625 Hannover
+49 511 532-9730
Ravens.Sarina@mh-hannover.de

Prof. Britta Eiz-Vesper
Institut für Transfusionsmedizin
Medizinische Hochschule Hannover
Carl-Neuberg-Str. 1
30625 Hannover
+49 511 532-9715
Eiz-Vesper.Brittamh-hannover.de