Die Etablierung persistierender Herpes-Simplex-Virus-Infektionen in Ganglien des peripheren Nervensystems
Ein bisschen Creme, ein paar Tage Geduld ‑ und Herpes scheint schnell geheilt. Die Infektion ist jedoch nicht besiegt, wenn die Bläschen von den Lippen oder im Genitalbereich wieder verschwinden. Alphaherpesviren verstecken sich in Nervenzellen und können immer wieder reaktiviert werden. Die WHO hat im Jahr 2012 geschätzt, dass etwa die Hälfte der Weltbevölkerung mit Herpes Simplex Virus Typ 1 und mehr als jeder 10. Mensch mit Herpes Simplex Typ 2 infiziert sind, auch wenn es nur bei einem Teil der Infizierten zu Krankheitssymptomen kommt (http://www.who.int/mediacentre/factsheets/fs400/en/).
Das Team um Beate Sodeik untersucht, wie die Herpes Simplex Viren in verschiedene menschliche Zellen eindringen und ihr Genom im Zellkern der Wirtszellen zur Expression bringen. Die Wissenschaftlerinnen untersuchen die Proteine der Wirtszellen, welche den in die Zelle eintretenden Herpesviren helfen, um die viralen Kapside zum Zellkern zu schicken, wo sie die viralen Genome durch die Kernporen in den Zellkern freisetzen. Im Zellkern werden die viralen Genome ausgelesen, um dann virale Proteine und neue Viruspartikel herzustellen und wieder frei zu setzen. Der aktuelle Schwerpunkt ihrer Untersuchungen ist die Infektion von Nervenzellen des peripheren Nervensystems, in denen Herpes Simplex Viren lebenslang persistieren. Die Wissenschaftlerinnen wollen die Regulierung dieser Faktoren in den unterschiedlichen menschlichen Zelltypen verstehen, um daraus mögliche neue Therapieansätze zu entwickeln.
Wissenschaftliche Vorgehensweise
In diesem Projekt wird ein experimentelles Modell für den Zelleintritt von HSV1 in Nervenzellen aufgebaut. So wollen die Forscher die durch HSV1 aktivierten intrazellulären Signalwege und die spezifischen Virus-Wirt-Interaktionen charakterisieren. Basis ist ein neu entwickeltes, polarisiertes Zellkultursystem aus sogenannten Microfluidic-Kammern. Sie erlauben den Wissenschaftlern einen selektiven Zugang zu den Nervenendigungen, wie sie auch in der Haut des Menschen infiziert werden. Hierzu kultiviert das Team primäre Nervenzellen aus den dorsalen Rückenmarksganglien von Mäusen. So kann die Gruppe selektiv die Somata oder die präsynaptische Plasmamembran am Ende der Axone mit Virus inokulieren. Dieses System eignet sich für die Infektion mit HSV1 sowie für HSV2.Für die Analyse des Zelleintritts werden neue von der Arbeitsgruppe hergestellte, rekombinante, fluoreszenzmarkierte HSV1-Stämme verwendet. Diese exprimieren ein oder zwei an virale Kapsid-, Tegument- oder Hüllproteine gekoppelte fluoreszierende Proteindomänen (mCherry, GFP). So kann das Forscherteam die intrazellulären Transportwege der einzelnen Viruskomponenten und ihre Interaktionen mit zellulären Strukturen in lebenden Zellen untersuchen, ein Beispiel dazu ist in dem Video unten zu sehen. Zudem kann analysiert werden, ob die virale Fusion mit der Plasmamembran, endozytotische HSV1-Eintrittswege, der axonale Transport oder die Ansteuerung der Kernporen nach Hemmung spezifischer Wirtsproteine der Nervenzellen blockiert sind.
Das Team charakterisiert die zellulären Mechanismen mittels derer die eintretende HSV1-Kapside mit den darin enthaltenen viralen Genomen von den Nervenendigungen zum Soma und dem Kern der Nervenzellen transportieren werden. Sie untersuchen mögliche Funktionen der Mikrotubuli-assoziierten Proteine Dynein, Dynactin und Kinesin-1 und von spezifischen Kernimportfaktoren und der Kernporenproteine. Viele dieser Wirtsproteine kommen in verschiedenen Isoformen vor und bilden Proteinkomplexe, deren Untereinheiten in verschiedenen Zelltypen unterschiedlich stark exprimiert sind. Die Forscher hemmen diese Proteine durch pharmakologische Hemmstoffe oder RNA-Interferenz mittels shRNA-Lentiviren. Die so behandelten Zellen werden infiziert, um die Auswirkungen der Hemmung auf den Zelleintritt von HSV1 in Nervenzellen untersuchen.
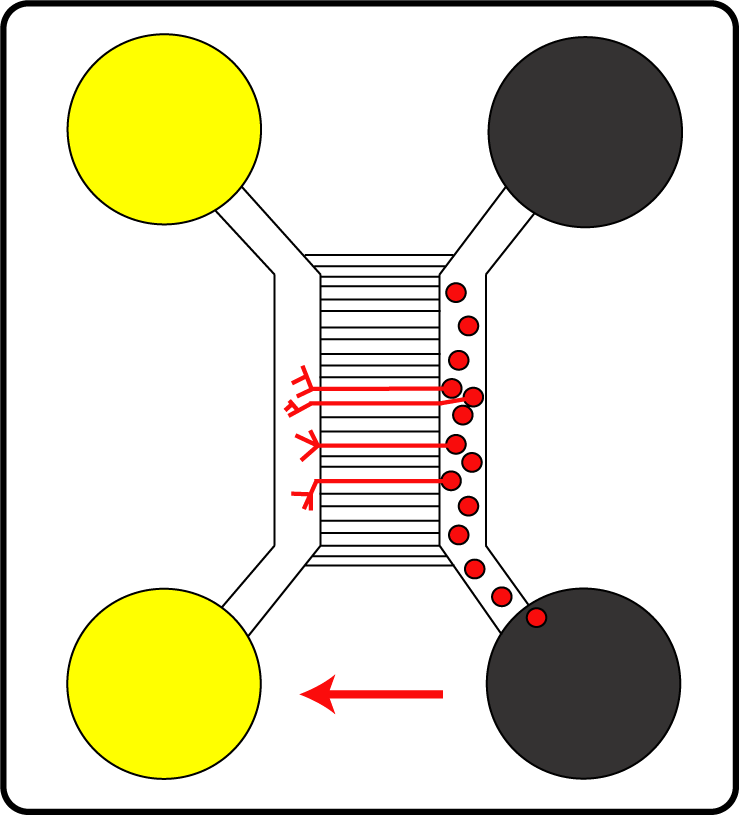
Primäre Nervenzellen (rote Punkte) in der mikrofluidischen Kammer: Die Nervenzellen wachsen und bilden Axone (rote Linien).
Lebendzelluntersuchungen des Eintritts von Herpes-Simplex-Viren in eine primäre Nervenzelle, die in einer speziellen mikrofluidischen Kammer kultiviert wurde.
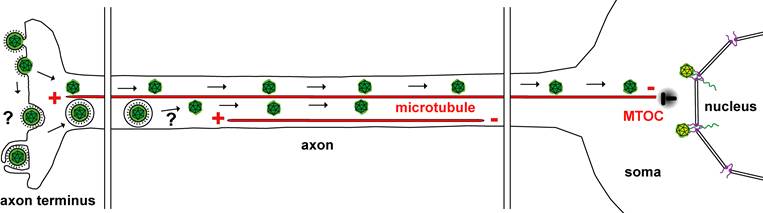
Alphaherpesviren (grün) treten an den Axonendigungen (axon terminus) über Fusion der viralen Membranhülle mit der axonalen Plasmamembran in die Nervenzelle ein. Herpes-Simplex-Viren in Endosomen oder die viralen ikosaedrischen Kapside (grün) werden entlang von Mikrotubuli von den Plusenden zu den Minusenden am Mikrotubuli-organisierenden Zentrum (MTOC) im Zellkörper der Nervenzelle transportiert. Die eintretenden Kapside docken an die Kernporen (lila) der Kernmembran an, und die viralen Genome (grün) werden durch die Kernporen in das Kernplasma frei gesetzt.

Elektronenmikroskopische Aufnahme eines HSV1-Kapsids (rot), welches an eine Kernpore (gelb) andockt und sein virales Genom (grün) in den von den beiden Kernmembranen (blau) umgebenen Zellkern injiziert.
Beate Sodeik erzählt über ihre Forschung im SFB 900
Beate Sodeik ist seit Gründung des SFBs im Jahr 2010 mit dabei und erforscht mit ihrem Team, wie Herpes Simplex Viren in verschiedene menschliche Zellen eindringen und ihr Genom im Zellkern der Wirtszellen zur Expression bringen. Vorrangig konzentriert sich die Arbeitsgruppe auf Infektionen der Nervenzellen.
Publikationen des Forschungsprojektes C2
Kontakt

Prof. Dr. rer. nat. Beate Sodeik
Institut für Virologie
Medizinische Hochschule Hannover
Carl-Neuberg-Str. 1
30625 Hannover
+49 511 532-2846
Sodeik.Beate@mh-hannover.de
