Die Funktion der viralen UL25-Proteine in der persistierenden Zytomegalievirus-Infektion
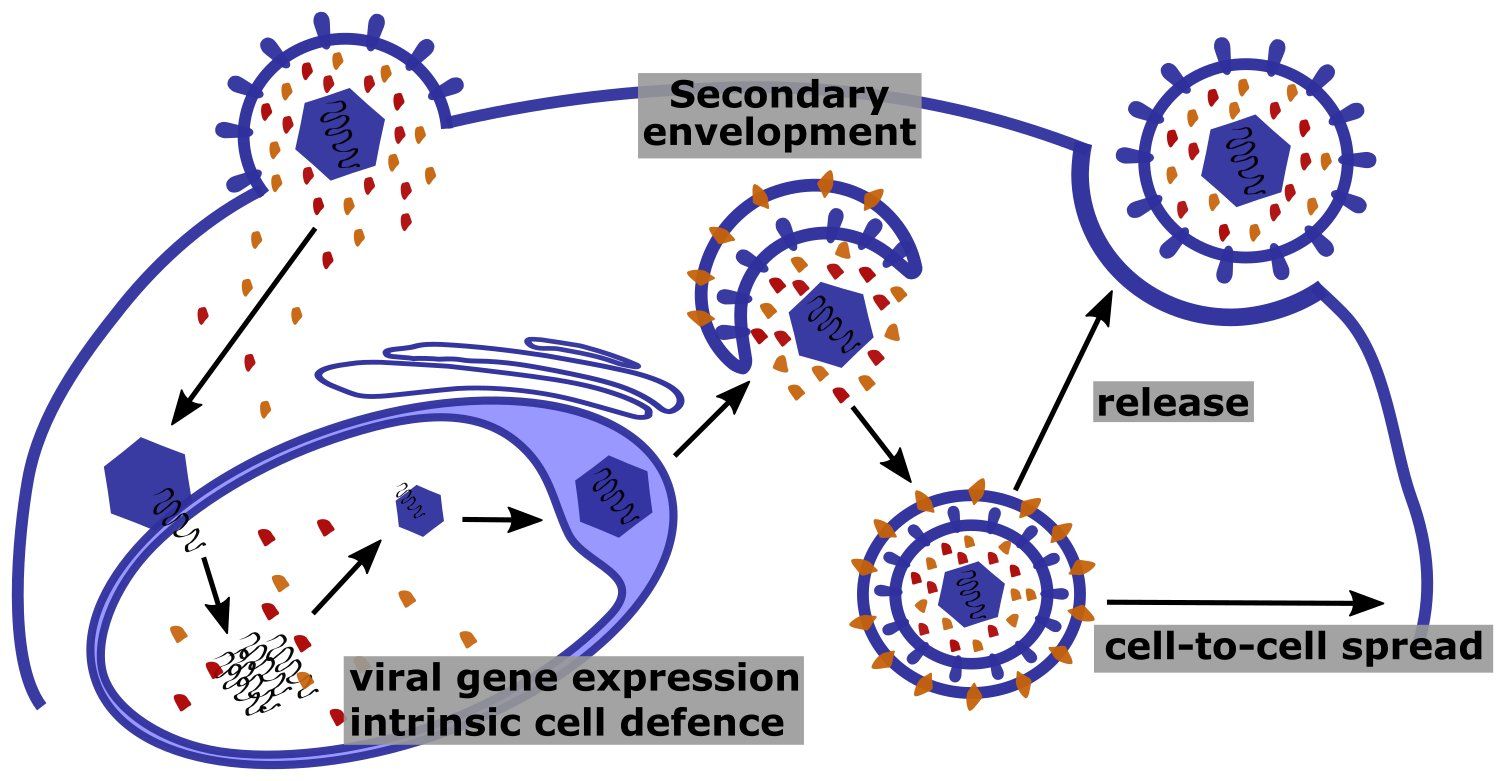
Funktion von Tegumentproteinen in der CMV-Infektion.
Tegumentproteine, wie die Mitglieder der UL25-Familie (orange und rot markiert), gelangen beim Viruseintritt zusammen mit dem Kapsid in die Zelle. Im Zellkern können Tegumentproteine intrinsischen Abwehrmechanismen entgegenwirken und damit die virale Genexpression fördern. Spät in der Infektion lokalisieren neu synthetisierte Tegumentproteine an zytoplasmatischen Membranen, um in Virionen eingebaut zu werden. Durch Anlagerung an die zytoplasmatische Seite von sekretorischen Vesikeln können Tegumentproteine zudem mit Komponenten des Cytoskeletts interagieren, und dadurch die Freisetzung von Virionen und den Transfer in benachbarte Zellen befördern.
In Industrieländern infiziert sich ungefähr jeder Zweite im Laufe des Lebens mit dem Zytomegalievirus (CMV). Meistens bleibt die Infektion aufgrund der leichten Symptome unbeachtet. Wie alle Herpesviren setzt sich CMV jedoch nach der initialen Infektion lebenslang in spezifischen Zelltypen fest. Gelegentlich erwacht das Virus aus diesem latenten Zustand („reaktiviert“) und wird dann in Körperflüssigkeiten (z.B. im Speichel) freigesetzt, um so auf andere Personen übertragen zu werden. Bei immungeschwächten Patienten (z. B. Transplantatempfängern) oder nach Infektion von ungeborenen Kindern während der Schwangerschaft kann CMV zu schweren lebensbedrohlichen Komplikationen führen. Das Verständnis, wie das Virus persistiert, d.h. in den ruhenden (latenten) Zustand eintritt und wieder aktiviert wird, ist Voraussetzung für die Entwicklung neuer Interventionsstrategien.
CMV kann eine ganze Reihe von verschiedenen Zelltypen infizieren und hat seinen Replikationszyklus eng an diese Zellen angepasst. Unabhängig davon, ob eine Infektion durch neu eintretende Virionen oder durch Reaktivierung aus der Latenz ausgelöst wird, muss das Virus die infizierten Zellen reprogrammieren, um eine effiziente Übertragung viraler Nachkommen auf Nachbarzellen sicherzustellen. In Geweben wird CMV ganz überwiegend durch direkte Zell-Zell-Kontakte weitergegeben.
Die Art und Weise, wie CMV die Ausbreitung von Zelle zu Zelle vermittelt, ist bisher wenig untersucht, vermutlich nutzt und beeinflusst das Virus für diesen Prozess jedoch das Zytoskelett der infizierten Zellen.
In diesem Projekt analysieren wir, wie die UL25-Proteine der Cytomegalieviren – eine bestimmte Klasse der viralen Tegumentproteine – das Zytoskelett verändern. Wir kombinieren virologische, biochemische und zellbiologische Techniken, um die Funktion der UL25-Proteine beim Zell-Zell-Transfer von CMV aufzuklären und neue zelluläre Prozesse zu definieren, die dabei beteiligt sind.
Wissenschaftliche Vorgehensweise
Die CMV-Infektion führt zu Veränderungen des Aktinzytoskeletts, wodurch die typische Vergrößerung und Abrundung infizierter Zellen hervorgerufen wird. Dieser Prozess ist so charakteristisch, dass er namensgebend für das Virus war.
Wir haben beobachtet, dass eine Mutante des murinen CMV (MCMV), welcher das M25-Gen fehlt, nicht in der Lage ist, den typischen zytopathischen Effekt zu induzieren. Weiterhin ist die Ausbreitung der Mutante in Zellkulturen beeinträchtigt, und die Replikation in vivo ist vermindert. Das MCMV M25-Protein, ein Mitglied der CMV UL25-Proteinfamilie, ist mengenmäßig eines der häufigsten Tegumentproteine dieses Virus. Unmittelbar nach Eintritt von MCMV in Zellen wird das M25-Protein in den Zellkern transportiert und assoziiert dort mit subnuklearen Strukturen (ND10-Bodies).
Später im Infektionszyklus ist das M25-Protein auch im Zytoplasma der infizierten Zellen nachweisbar. Isolierte Expression des M25-Proteins unabhängig von der Virusinfektion führt zu morphologischen Veränderungen von Zellen; dies bestätigt, daß das M25-Protein die Remodellierung des Zytoskeletts verursacht und somit die Ausbreitung von MCMV von Zelle zu Zelle unterstützt.
Zur Untersuchung des molekularen Wirkungsmechanismus von M25 wurden Co-Immun-präzipitationsexperimente gekoppelt mit SILAC-basierter Massenspektrometrie durchgeführt und potentielle zelluläre Bindungspartner von M25 identifiziert. Wir werden nun analysieren, welche der Protein-Protein-Interaktionen die Veränderungen des Zytoskeletts bewirken, und welche zellulären Signalwege hierzu beeinflusst werden. Weiterhin werden wir prüfen, welche der identifizierten Interaktionspartner bzw. der M25-regulierten Signalwege auch Zielstrukturen der UL25-Proteine des humanen CMV darstellen. Ziel des Projektes ist es, die molekularen Mechanismen aufklären, welche der Übertragung von CMV von Zelle zu Zelle und damit der Persistenz des Virus zugrunde liegen.
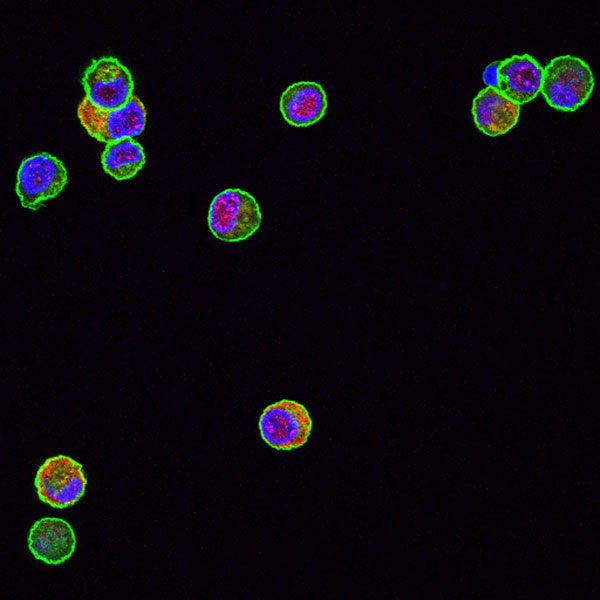
Die MCMV-M25-Deletionsmutante induziert keinen typischen zytopathischen Effekt. Fibroblasten, infiziert mit Wildtyp-MCMV.
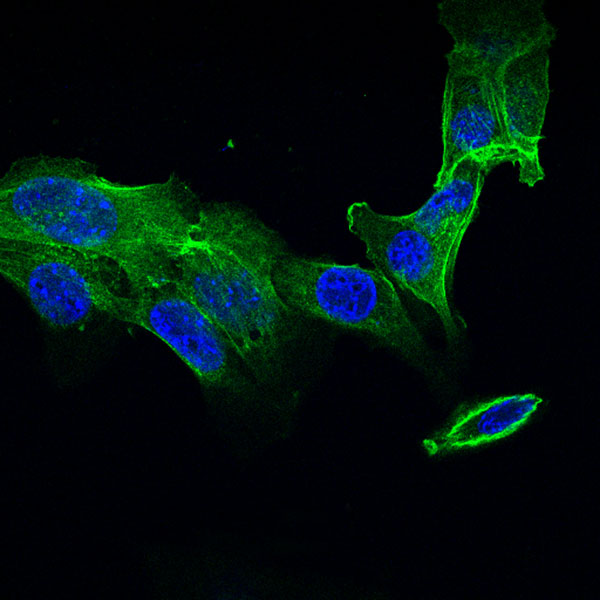
Die MCMV-M25-Deletionsmutante induziert keinen typischen zytopathischen Effekt. Fibroblasten wurden mit Wildtyp-MCMV (links) oder der M25-Deletionsmutante (rechts) infiziert und mit einem M25-spezifischen Antikörper (rot) und mit Phalloidin (grün) behandelt, um Aktinfasern anzufärben.
Martin Messerle erzählt über seine Forschung im SFB 900
Martin Messerle ist dem SFB mit dem Teilprojekt C6 in der 2. Förderperiode im Jahr 2014 beigetreten. Er und seine Mitarbeiter erforschen in diesem Projekt die Rolle der viralen Proteine von Zytomegalieviren bei der Wirtsabwehr.
Publikationen des Forschungsprojektes C6
Kontakt

Prof. Dr. rer. nat. Martin Messerle
Institut für Virologie
Medizinische Hochschule Hannover
Carl-Neuberg-Str. 1
30625 Hannover
+49 511 532-4320
Messerle.Martin@mh-hannover.de