Immunmodulation und Kolonisierung sensorischer Ganglien durch Alpha-Herpesviren
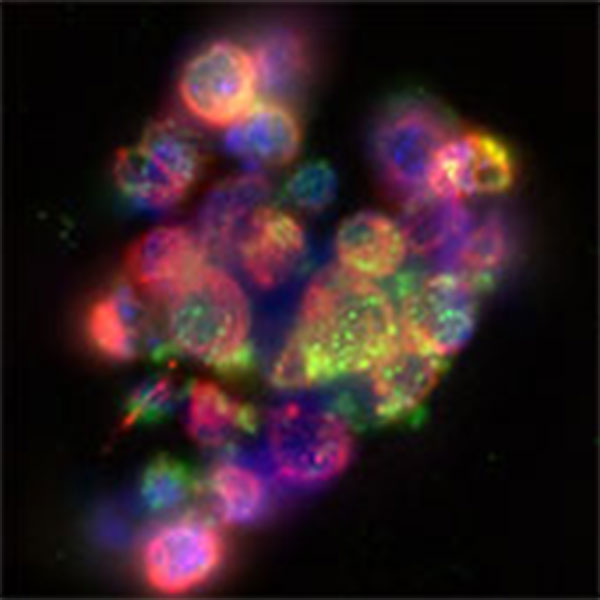
Abbildung 1: Vero Zellen infiziert mit einem mCherry-exprimierenden HSV-2 Virus. Magenta: Tubulin; Blau: DAPI; Grün: anti-HSV Serum; Rot: mCherry.
Seit Millionen von Jahren ist die Evolution von Herpesviren mit der ihrer Wirtsorganismen gekoppelt. Daher enthalten Herpesviren in ihrem genetischen Code die Informationen, um komplexe Wirt-Pathogen Interaktionen zu verstehen, wie z.B. den viralen Replikationszyklus, Immunmodulation des Wirts oder Pathogenese. Daher ermöglicht das Studium dieser Interaktionen die Entwicklung neuer anti-viraler Strategien und kann umgekehrt Einsichten in grundlegende Mechanismen und Funktionen des Wirtsorganismus liefern.
Unter den humanen Herpesviren kolonisieren und persistieren Herpes Simplex Typ 1, Typ 2 (HSV1, bzw. HSV2) und Varizella-Zoster Virus (VZV) in Neuronen, da sie fähig sind, das Nervensystem des Wirts zu beeinflussen. Der Erfolg einer Infektion ist dabei extrem von der viralen Modulierung des Wirtsimmunsystems und einer erfolgreichen Kolonisierung des Nervensystems abhängig. Nach erfolgreicher Primärinfektion etablieren diese Viren darüber hinaus lebenslange Latenz in spezifischen neuronalen Subtypen, aus der sie durch spezifische Stimuli reaktiviert werden können.
Die Mehrheit Erwachsener ist mit HSV1 und VZV infiziert, wobei die Primärinfektion normalerweise bereits in der Kindheit stattfindet. Im Gegensatz dazu sind weniger Individuen HSV2 positiv, da HSV2 hauptsächlich sexuell übertragen und daher erst in späteren Lebensabschnitten erworben wird. HSV1 und HSV2 verursachen eine Reihe verschiedener Krankheitsbilder, wie z.B. Lippenherpes, Blindheit, verursacht durch Herpes Simplex Keratitis, schmerzhafte Geschwüre an den Genitalien oder gar Hirnhautentzündung. VZV verursacht Windpocken (Varizella) während der Primärinfektion und Gürtelrose (Zoster), assoziiert mit akuten Schmerzen, durch eine Reaktivierung des latenten Virus. Ein gewisser Prozentsatz von Patienten mit Zoster leiden danach unter post herpetischer Neuralgie, chronischen Schmerzen, die nach dem Abklingen der Gürtelrose für Monate andauern können.
Das Fernziel unserer Forschung ist besser zu verstehen wie HSV1, HSV2 und VZV das Immun- und Nervensystem des Wirts modulieren, letztendlich um neue anti-virale Wirkstoffe, Impfstoffe und Immunmodulatoren zu entwickeln. Unmittelbar konzentrieren wir unsere Forschungsarbeit im Moment darauf, zu verstehen wie diese Viren Chemokine und neurotrophe Wachstumsfaktoren beeinflussen, Faktoren die in der Kommunikation zwischen Immun- und Nervensystem eine zentrale Rolle spielen.
Wissenschaftliche Vorgehensweise
Herpes Simplex Virus Typ 1, Typ 2 (HSV1, HSV2) und Varizella-Zoster Virus (VZV) sind neurotrophe humane Viren mit hoher Prävalenz, die Latenz in den Neuronen des peripheren Nervensystems etablieren. Die Infektion des Nervensystems ist notwendig für die Pathogenese und mehrere Publikationen deuten darauf hin dass HSV1 und HSV2 in unterschiedlichen Subtypen von Neuronen Latenz etablieren. Diese Viren modulieren das Wirtsimmunsystem während der Primärinfektion, der Etablierung von Latenz und Reaktivierung.
In Vorarbeiten konnten wir in Kollaboration mit Antonio Alcami (CBM, Madrid, Spain) zeigen dass Glykoprotein G von HSV1 (gG1) und HSV2 (gG2) Chemokine binden und deren Aktivität erhöhen können, was zu einer verstärkten Leukozyten Migration führt. In ähnlicher Weise binden beide Proteine Nerve Growth Factor (NGF) aber nur gG2 erhöht die NGF Aktivität, was zu verstärkter Bildung von Neuriten in NGF-Rezeptor (TrkA) positiven Neuronen führt. Dies könnte förderlich für die Infektion bestimmter Subtypen von Neuronen sein, da TrkA normallerweise von peptidergen Neuronen exprimiert wird. Diese Neuronen wiederum sind mit der Wahrnehmung von Schmerzen assoziiert, einem Symptom charakteristisch für genitalen Herpes. Um festzustellen ob gG1 und gG2 eine Rolle im Gewebetropismus und der Pathogenese spielen, haben wir in Kollaboration mit Beate Sodeik (Projekt C2) Mutanten hergestellt die entweder kein gG mehr exprimieren oder es mit dem entsprechenden Gegenstück aus HSV1 bzw. HSV2 ausgetauscht. All diese genetisch veränderten Viren exprimieren mCherry und gaussia Luciferase um ihre Detektion in vitro, ex vivo und in vivo zu erleichtern. Wir charakterisierten diese rekombinanten Viren in vitro und konnten zeigen dass der Verlust der gG-Expression keinen Einfluss auf die Replikation hat.
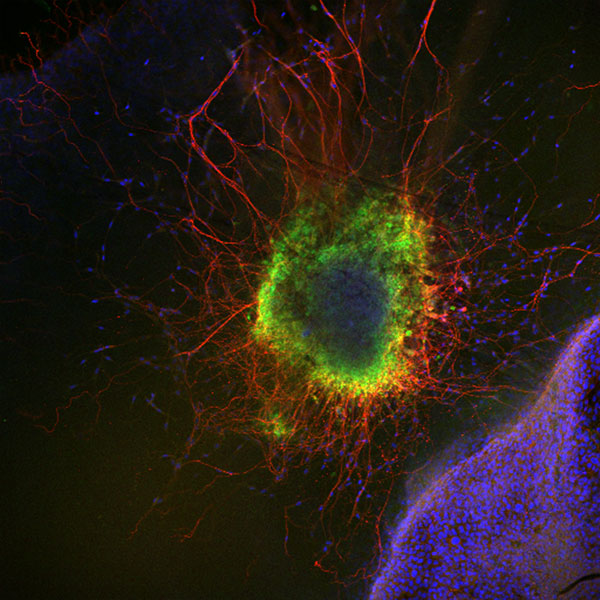
Abbildung 2: Maus superiores Zervikalganglion mit benachbarten Keratinozytenzyten (HaCat). Es wurde der NGF-Rezeptor TrkA angefärbt. Grün: TrkA; Rot, beta-III Tubulin; Blau: DAPI.
Im Moment untersuchen wir, in Kollaboration mit Antonio Alcami, den Einfluss dieser Veränderungen auf die Infektion spezifischer Subtypen von Neuronen in explantierten Ganglien und in vereinzelten Neuronen in Mikrofluidkammern. Wir untersuchen welche Rolle gG in der Pathogenese spielt und konzentrieren uns dabei auf Immunmodulation und die Kolonisierung des Nervensystems in vivo. Unsere Untersuchungen werden neue Erkenntnisse zur Relevanz der Modulation von Chemokinen und neurotropher Faktoren durch HSV liefern und Informationen zur Entwicklung neuer anti-viraler Strategien.
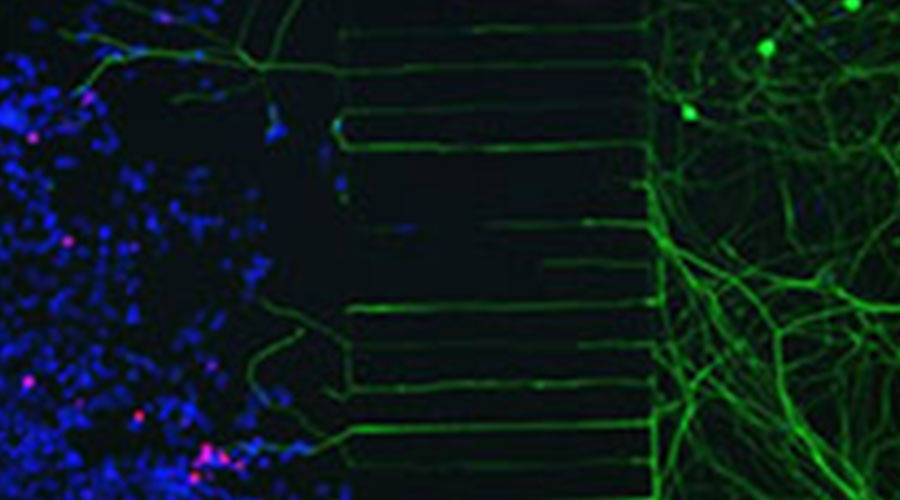
Abbildung 3: Microfluidkammer mit 293-T Zells infiziert mCherry-expremierendem HSV2 Virus. Auf der linken Seite der Mikrokanäle wurden die infizierten 293T-Zellen zugegeben, auf der rechten Seite die Neuronen. Neu gebildete Nervenenden wachsen durh die Mikrokanäle und erreichen die infizierten Zellen. Rot: mCherry; Grün: beta-III Tubulin; Blau, DAPI.
Andere Kollaborationen innerhalb des SFB 900:
In unserem Projekt zur Charakterisierung neuer anti-virale Wirtsproteine arbeiten wir mit Christine Goffinet (Projekt C7) an der Entdeckung neuer antiviraler Mechanismen gegen humane Pathogene. Während dieser Förderperiode haben wir ein neues Projekt mit Thomas Krey (Projekt B10) begonnen, um die Kristallstruktur eines viralen Chemokin Bindeproteins (vCKBP) aufzuklären. Diese Zusammenarbeit wird die Identifizierung der vCKBP Domäne erleichtern die an der Interaktion mit Chemokinen und der grundlegenden Funktionalität des vCKBPs beteiligt ist. Wir verwenden Surface Plasmon Resonanz (SPR) auf einem vom SFB900 zentral angeschafften Biacore X-100, um die Interaktion zwischen viralen Proteinen und Zytokinen bzw. neurotropher Faktoren zu untersuchen. Weiterhin arbeiten wir mit und unterstützen wir andere Gruppen die mit SPR arbeiten wollen im Rahmen des SFB900.
Abel Viejo Borbolla erzählt über seine Forschung im SFB 900
Abel Viejo Borbolla ist dem SFB in der 2. Förderperiode im Jahr 2014 beigetreten. Er und seine Mitarbeiter widmen sich im Teilprojekt B9 der Fragestellung, wie Herpes-Simplex-Viren Nervenzellen dauerhaft besiedeln können.
Publikationen des Forschungsprojektes B9
Kontakt

Juniorprof. PhD Abel Viejo Borbolla
Institut für Virologie
Medizinische Hochschule Hannover
Carl-Neuberg-Str. 1
30625 Hannover
+49 511 532-4382
Viejo-Borbolla.Abel@mh-hannover.de